2021年2月24日,國家藥品監(jiān)督管理局藥品審批中心(CDE)官網(wǎng)顯示,德琪醫(yī)藥選擇性核輸出抑制劑(Selective Inhibitor of Nuclear Export,簡稱“SINE”)ATG-010(selinexor,XPOVIO®)的新藥上市申請(NDA)納入優(yōu)先審評審批程序。
擬定適應(yīng)癥(或功能主治)為:ATG-010片與地塞米松聯(lián)用,治療既往接受過治療且對至少一種蛋白酶體抑制劑,一種免疫調(diào)節(jié)劑以及一種抗CD38單抗難治的復(fù)發(fā)或難治性多發(fā)性骨髓瘤。
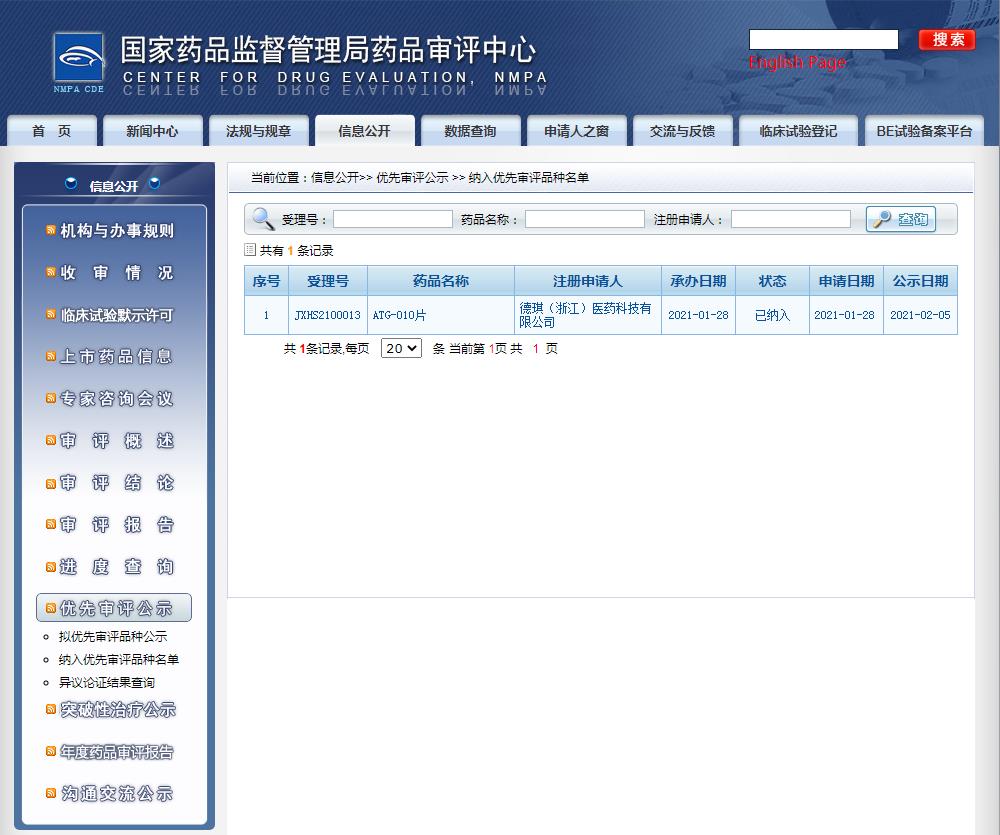
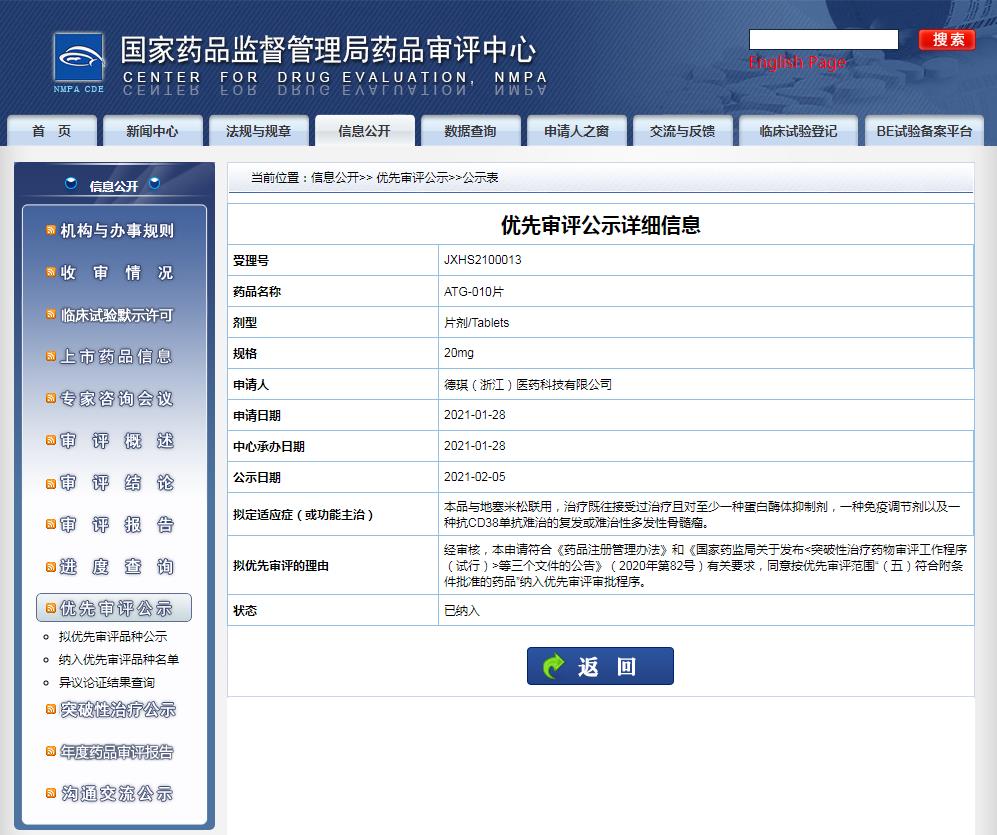
圖片來源:CDE官網(wǎng)截圖
ATG-010(selinexor,XPOVIO®)是一款口服型選擇性核輸出抑制劑(SINE)化合物,可引起腫瘤抑制蛋白和其他生長調(diào)節(jié)蛋白的核內(nèi)儲留和活化,以及下調(diào)細胞漿內(nèi)的多種致癌蛋白水平,并且會在體外和體內(nèi)誘導(dǎo)腫瘤細胞凋亡,而不對正常細胞產(chǎn)生影響。
美國食品藥品監(jiān)督管理局(FDA)在18個月內(nèi)批準了ATG-010(selinexor)用于治療3種血液瘤適應(yīng)癥。而且,美國國家綜合癌癥網(wǎng)絡(luò)(NCCN®)指南也納入了ATG-010治療多發(fā)性骨髓瘤和彌漫性大B細胞淋巴瘤的5種治療方案。
德琪醫(yī)藥已完成在中國大陸進行注冊臨床試驗的患者入組,并且在過去6個月中向5個亞太市場(包括澳大利亞、韓國及新加坡等在內(nèi))提交了新藥上市申請。
關(guān)于ATG-010(selinexor,XPOVIO®)
ATG-010是一個獲得批準的SINE化合物,由Karyopharm Therapeutics Inc.研發(fā),德琪醫(yī)藥進行研究。德琪醫(yī)藥已經(jīng)在包括大中華區(qū)、新西蘭、澳大利亞、南韓和東盟國家在內(nèi)的多個亞太市場獲得了ATG-010的開發(fā)和商業(yè)化權(quán)利。
祝賀ATG-010這款產(chǎn)品被NMPA授予優(yōu)先審評,期待ATG-010的盡快獲批,使更多的復(fù)發(fā)或難治性多發(fā)性骨髓瘤患者早日獲得新的治療選擇。
訂購需求
- *聯(lián)系人
- *聯(lián)系電話
- *咨詢品種
- 特殊備注
如緊急,請撥打
400-168-0606電話咨詢。




