2021年5月7日,北京珅諾基醫藥科技(盛諾基子公司)提交的阿可拉定軟膠囊上市申請獲得了國家藥品監督管理局(NMPA)藥品審評中心(CDE)并擬納入優先審評,用于治療既往未接受過全身系統性治療的不可切除的肝細胞癌。
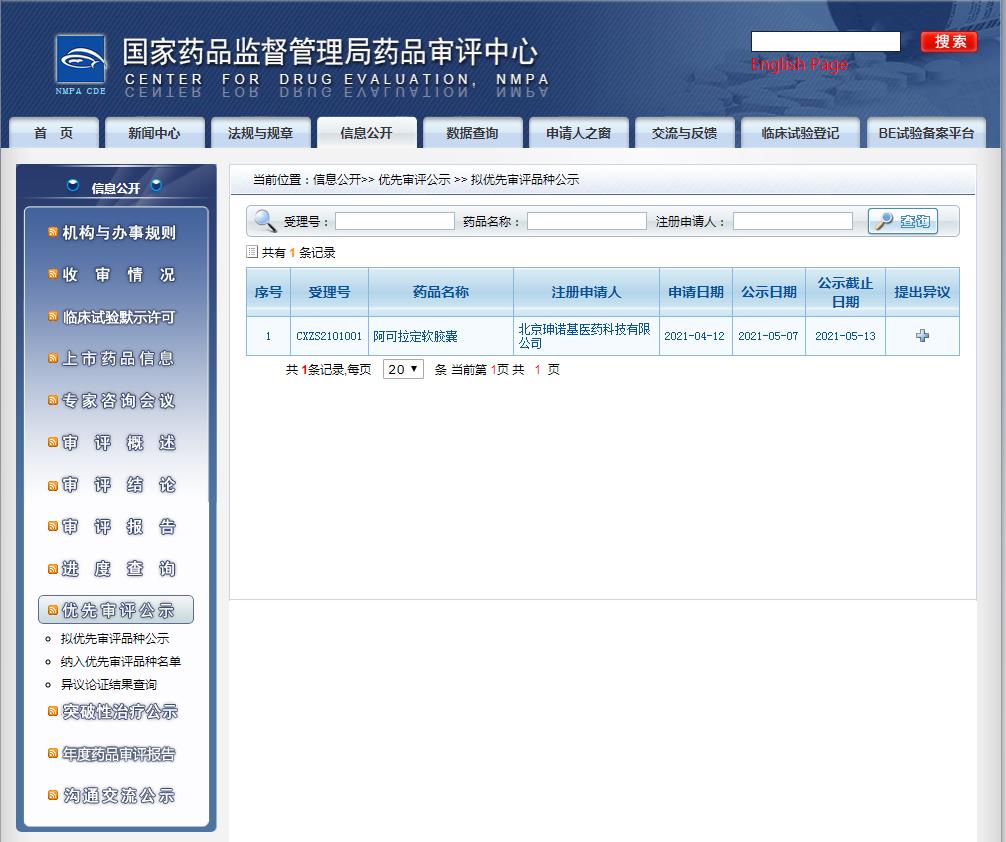
圖片來源:CDE
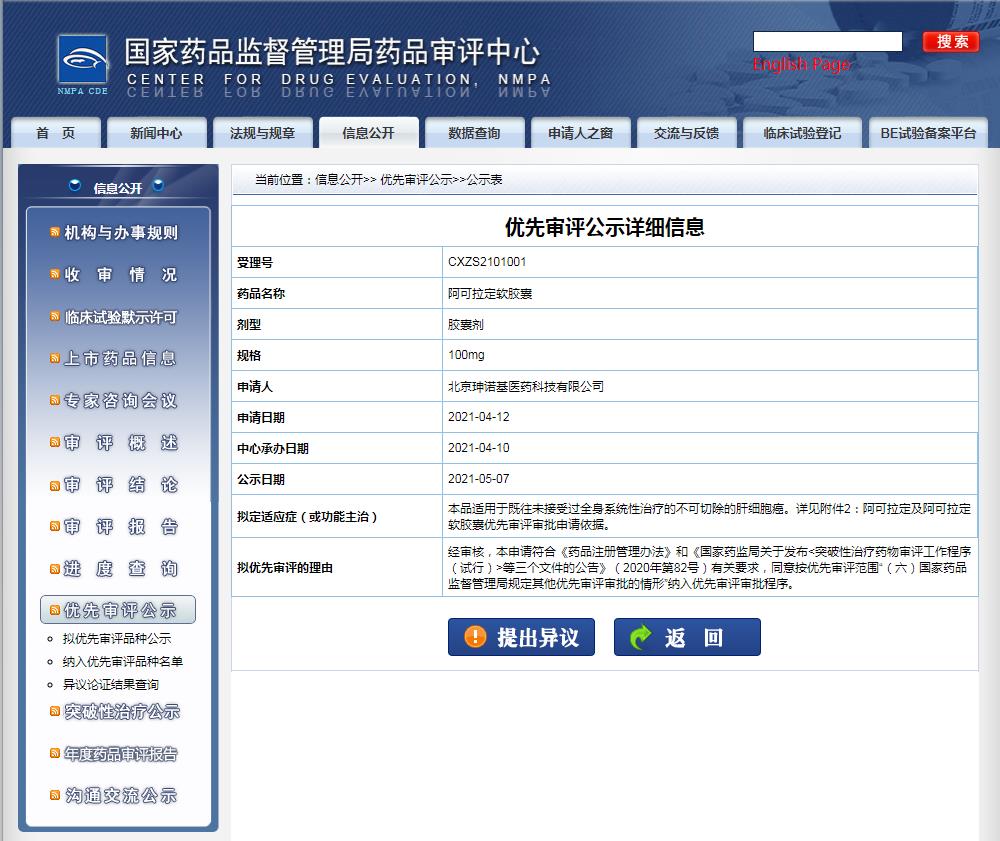
阿可拉定(SNG-162)由珅奧基醫藥研究開發擁有自主知識產權的1類新藥,是從淫羊藿中提取、分離、純化得到的活性藥物單體,用于治療晚期肝癌,是繼青蒿素之后中藥現代化的又一重大突破。

圖片來源:CDE
阿可拉定最早于2008年11月在我國申報臨床,并于2015年11月申報生產(CXZS1500023)進入了CDE,該藥是重大專項品種,按特殊審批品種審評。2016年阿可拉定軟膠囊的上市申請被列入了第2批181個臨床自查藥品清單,同年的8月12日審批完畢,審批結論為“不批準”。
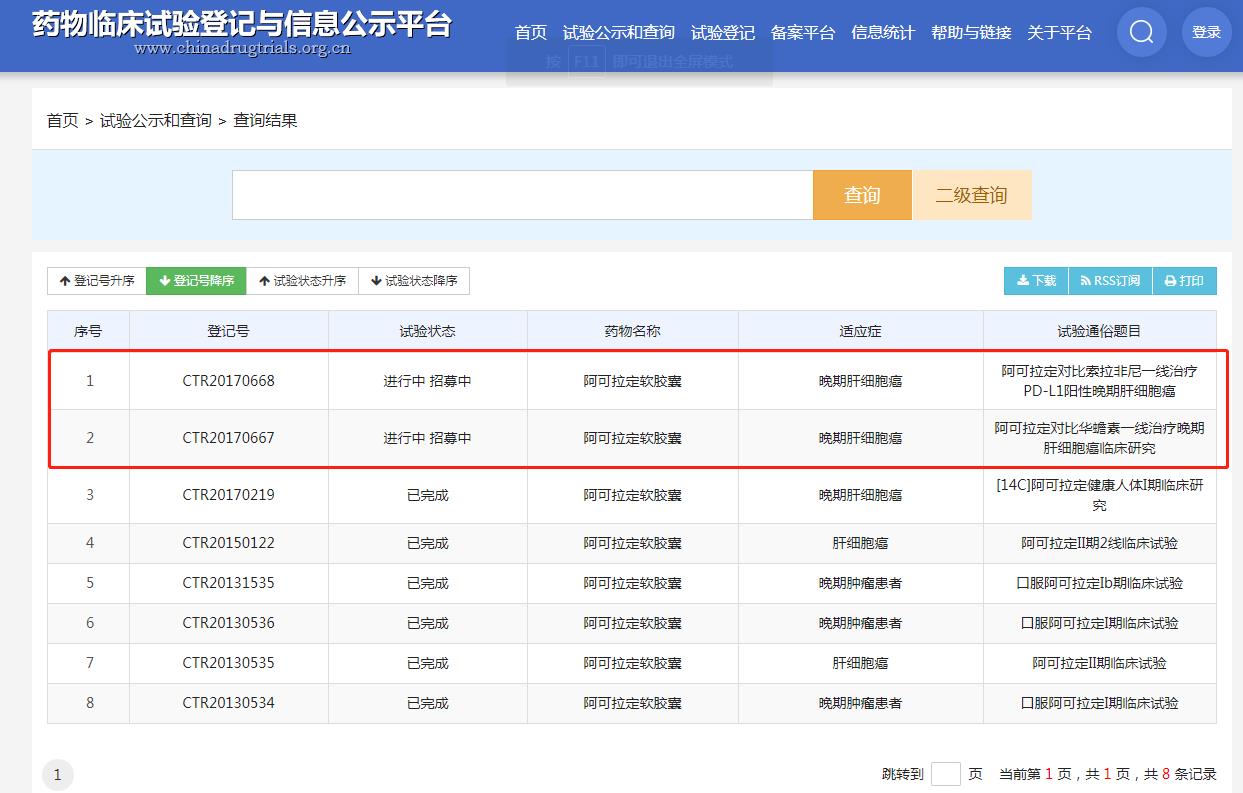
圖片來源:藥物臨床試驗登記與信息公示平臺
根據早前消息,應CDE要求,盛諾基開展了一項阿可拉定對比華蟾素一線治療晚期肝細胞癌的III期臨床試驗。除了與華蟾素的比較外,也開展一項阿可拉定對比索拉非尼一線治療晚期肝細胞癌的III期臨床試驗。盛諾基于2021年1月6日宣布,阿可拉定 vs. 華蟾素一線治療晚期肝細胞癌患者的全國多中心注冊III期臨床試驗期中分析達到了預設的主要研究終點。
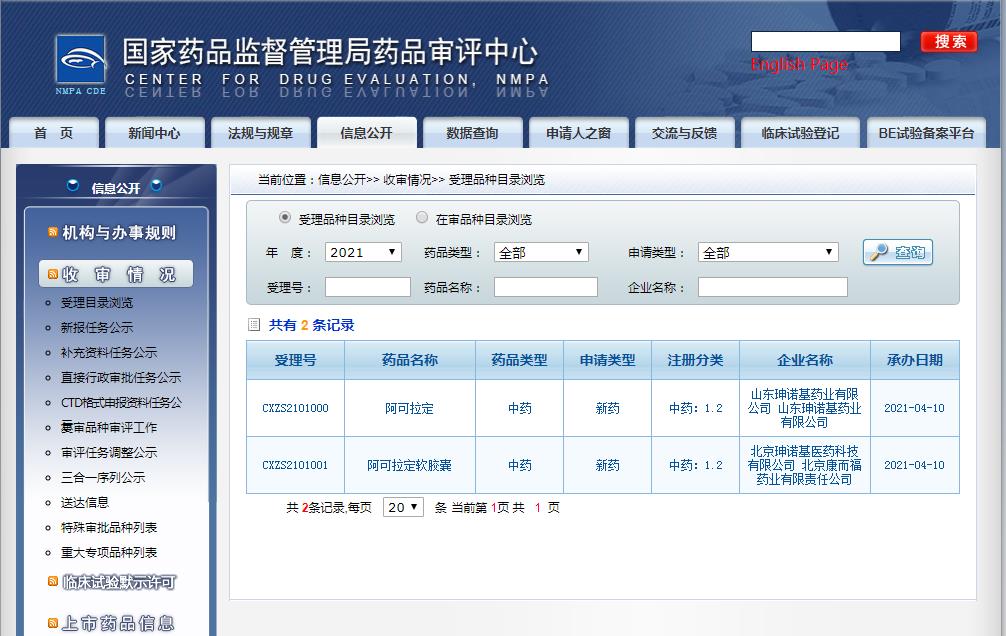
圖片來源:CDE
之后,在2021年4月10日,珅奧基重新按中藥注冊分類 1.2類遞交了阿可拉定的上市申請。
訂購需求
- *聯系人
- *聯系電話
- *咨詢品種
- 特殊備注
如緊急,請撥打
400-168-0606電話咨詢。




