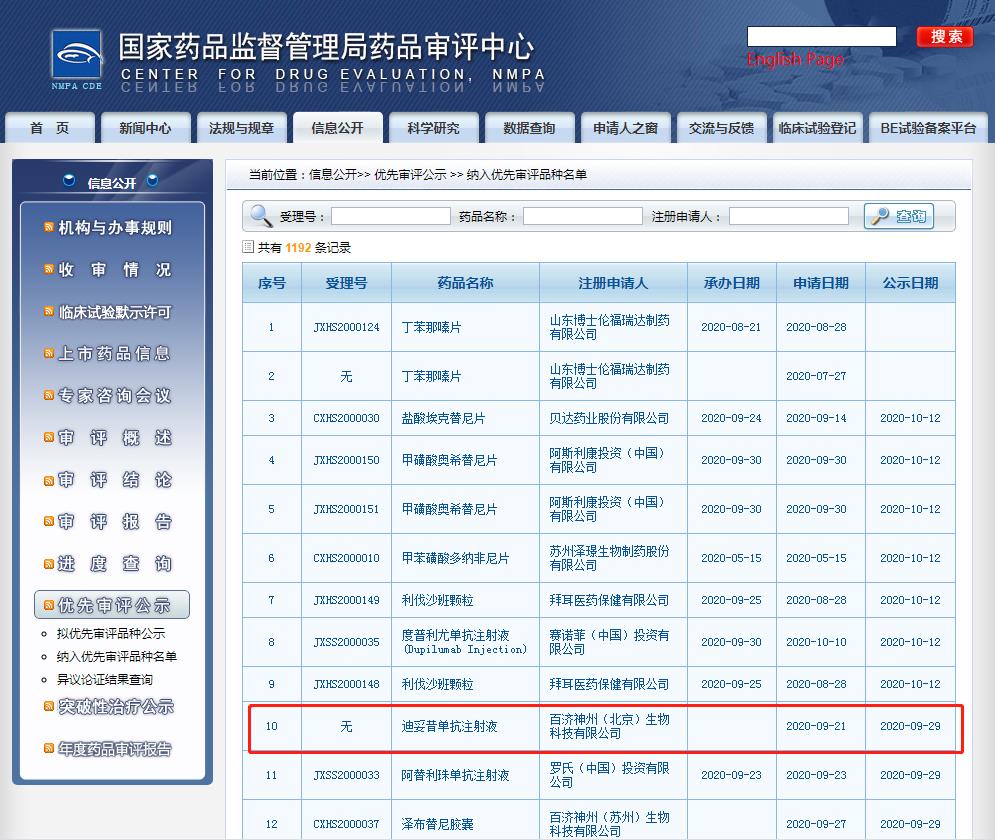
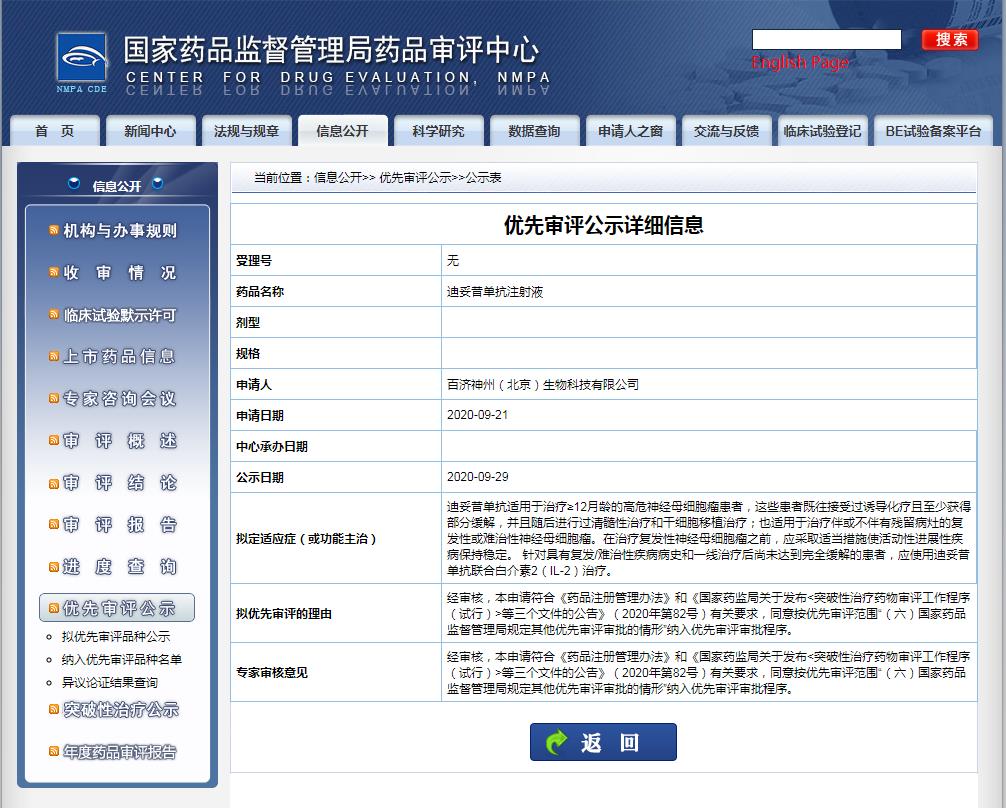
2020年9月29日,百濟(jì)神州的迪妥昔單抗注射液上市申請已經(jīng)被國家藥品監(jiān)督管理局藥品審評中心(CDE)受理并納入優(yōu)先審評審批程序。


圖|國家藥品監(jiān)督管理局官網(wǎng)
迪妥昔單抗注射液擬定適應(yīng)癥(或功能主治)為:迪妥昔單抗適用于治療≥12月齡的高危神經(jīng)母細(xì)胞瘤患者,這些患者既往接受過誘導(dǎo)化療且至少獲得部分緩解,并且隨后進(jìn)行過清髓性治療和干細(xì)胞移植治療;
也適用于治療伴或不伴有殘留病灶的復(fù)發(fā)性或難治性神經(jīng)母細(xì)胞瘤。在治療復(fù)發(fā)性神經(jīng)母細(xì)胞瘤之前,應(yīng)采取適當(dāng)措施使活動性進(jìn)展性疾病保持穩(wěn)定。 針對具有復(fù)發(fā)/難治性疾病病史和一線治療后尚未達(dá)到完全緩解的患者,應(yīng)使用迪妥昔單抗聯(lián)合白介素2(IL-2)治療。


圖|國家藥品監(jiān)督管理局官網(wǎng)
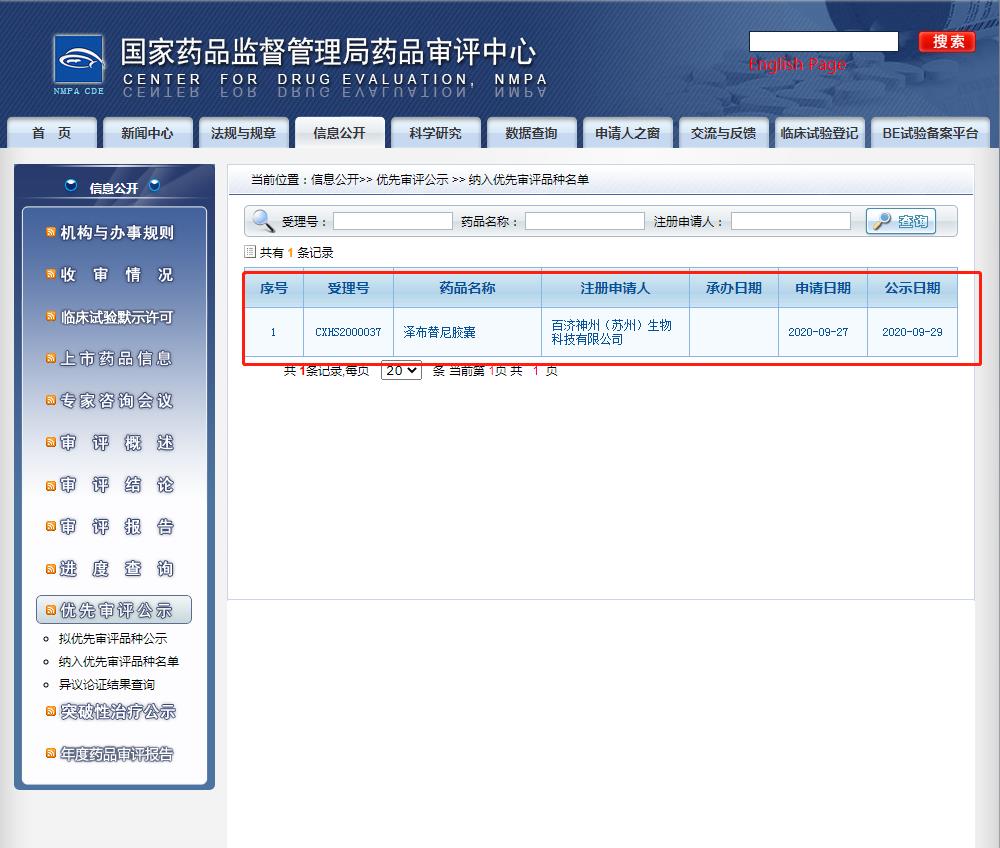
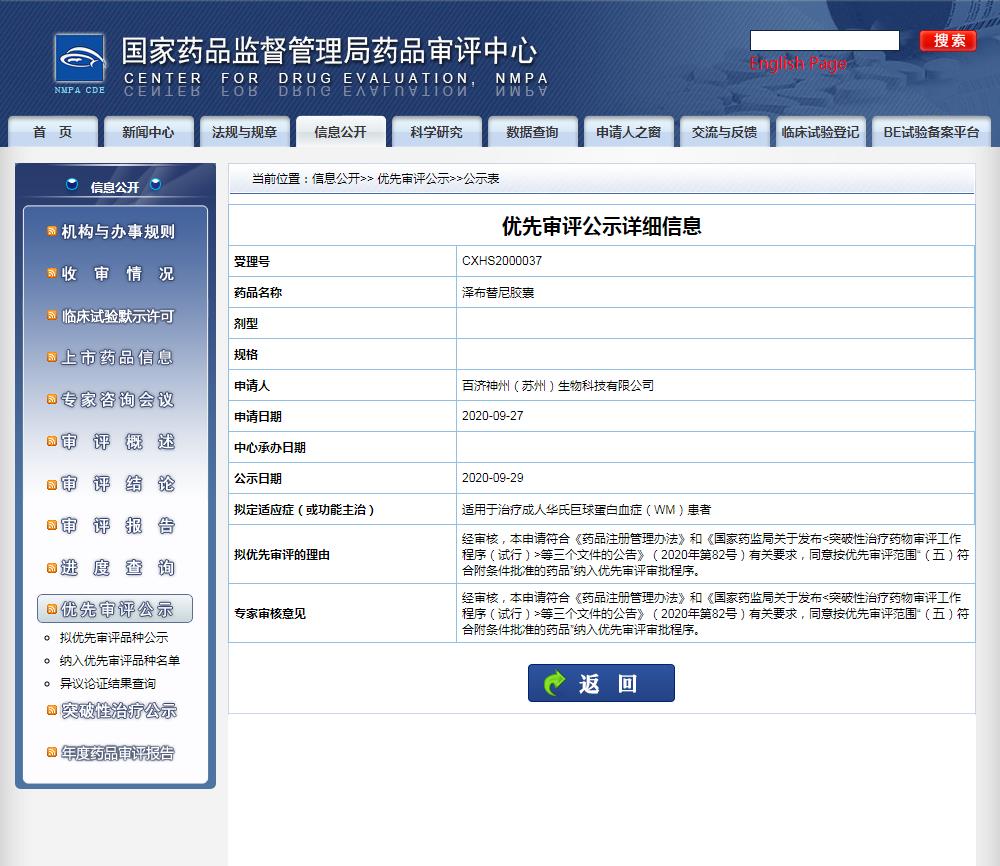
同時,CDE官網(wǎng)最新公示中,顯示了百濟(jì)神州也在中國提交了澤布替尼膠囊第3項適應(yīng)癥上市申請,適用于治療成人華氏巨球蛋白血癥(WM)患者。該適應(yīng)癥申請也擬納入了優(yōu)先審評審批程序。
訂購需求
- *聯(lián)系人
- *聯(lián)系電話
- *咨詢品種
- 特殊備注
如緊急,請撥打
400-168-0606電話咨詢。




