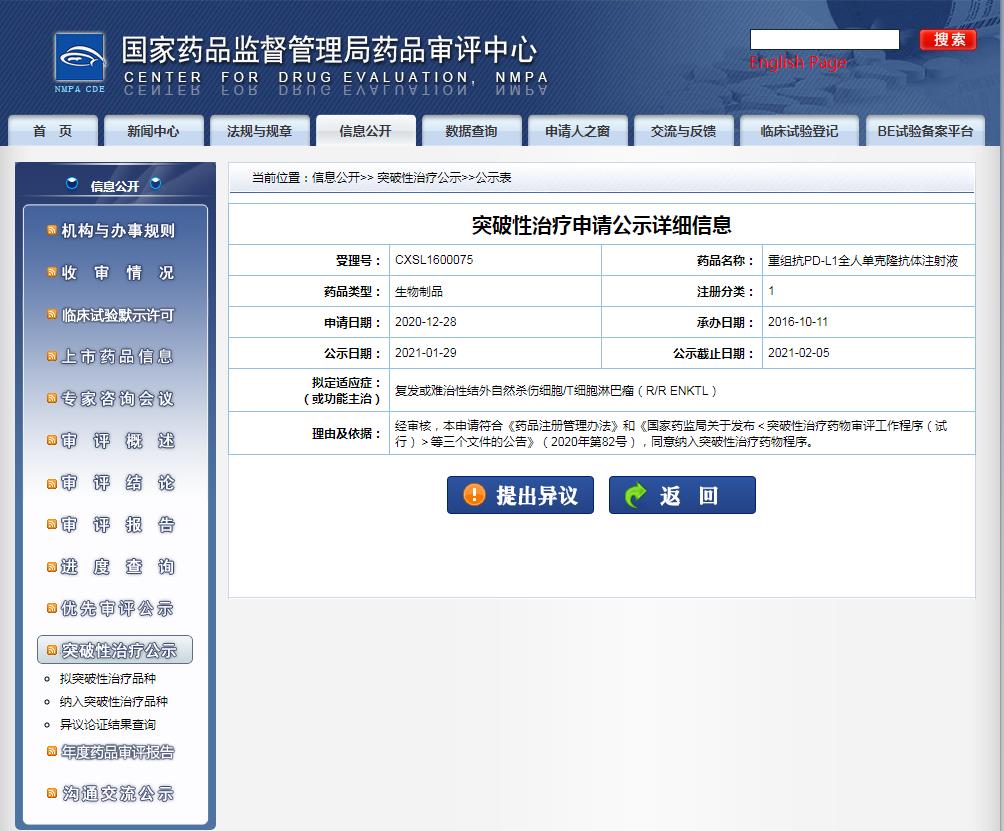
2021年1月29日,基石藥業提交的1類生物新藥重組抗PD-L1全人單克隆抗體注射液獲得國家藥監局藥品審評中心(CDE)擬納入突破性治療品種,擬定的適應癥(或功能主治)為:復發或難治性結外自然殺傷細胞/T細胞淋巴瘤(R/R ENKTL)。
研發代號是CS1001(舒格利單抗)的重組抗PD-L1全人單克隆抗體注射液,在2020年10月已經獲得美國FDA授予的突破性療法認定,用于單藥治療成人R/R ENKTL。
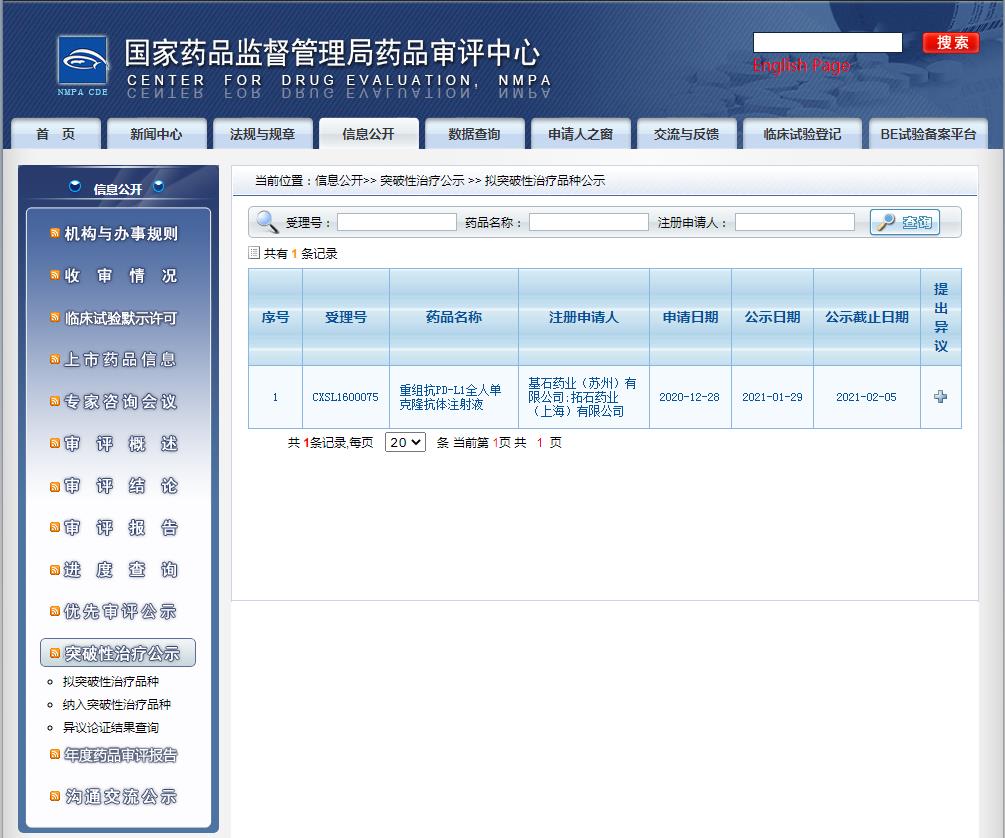
截圖來源:CDE官網
在2020年11月,國家藥監局藥品審評中心(CDE)已受理舒格利單抗(CS1001,抗PD-L1單抗)用于聯合化療一線治療晚期鱗狀和非鱗狀非小細胞肺癌患者的上市申請。
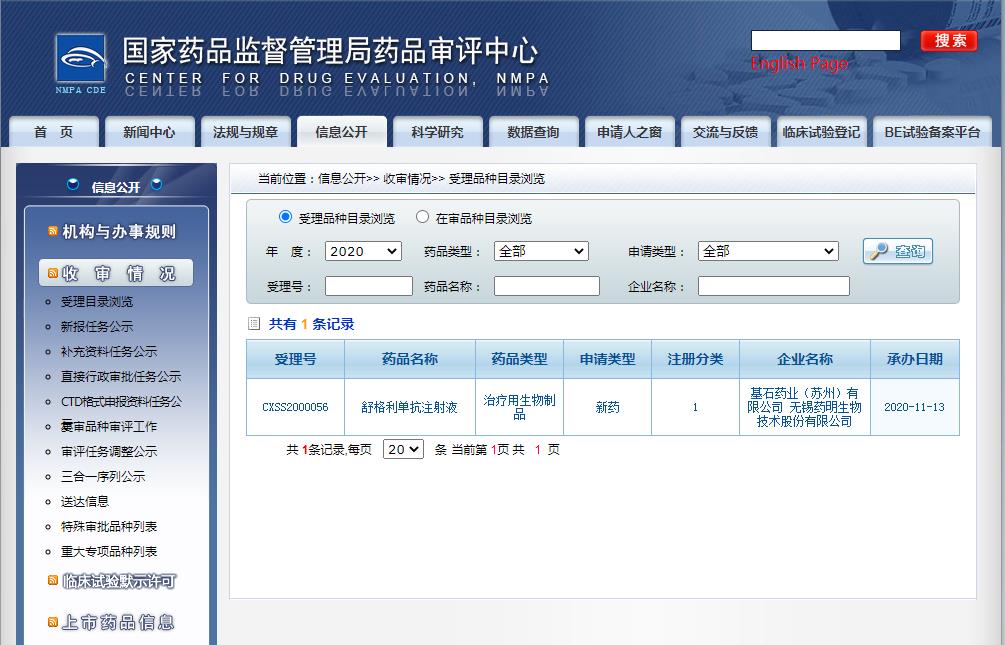
截圖來源:CDE官網
CS1001這次獲得國家藥監局藥品審評中心擬納入突破性治療品種的適應癥為:復發或難治性結外自然殺傷細胞/T細胞淋巴瘤。這是一種侵襲性強、預后差的惡性淋巴瘤。患者在含門冬酰胺酶為基礎的標準方案失敗后,缺乏挽救治療手段。由于該疾病危險,發展迅速,生存期短,生存率低。因此,一線治療方案失敗后的患者現如今面臨明顯的未被滿足治療需求和應對策略。
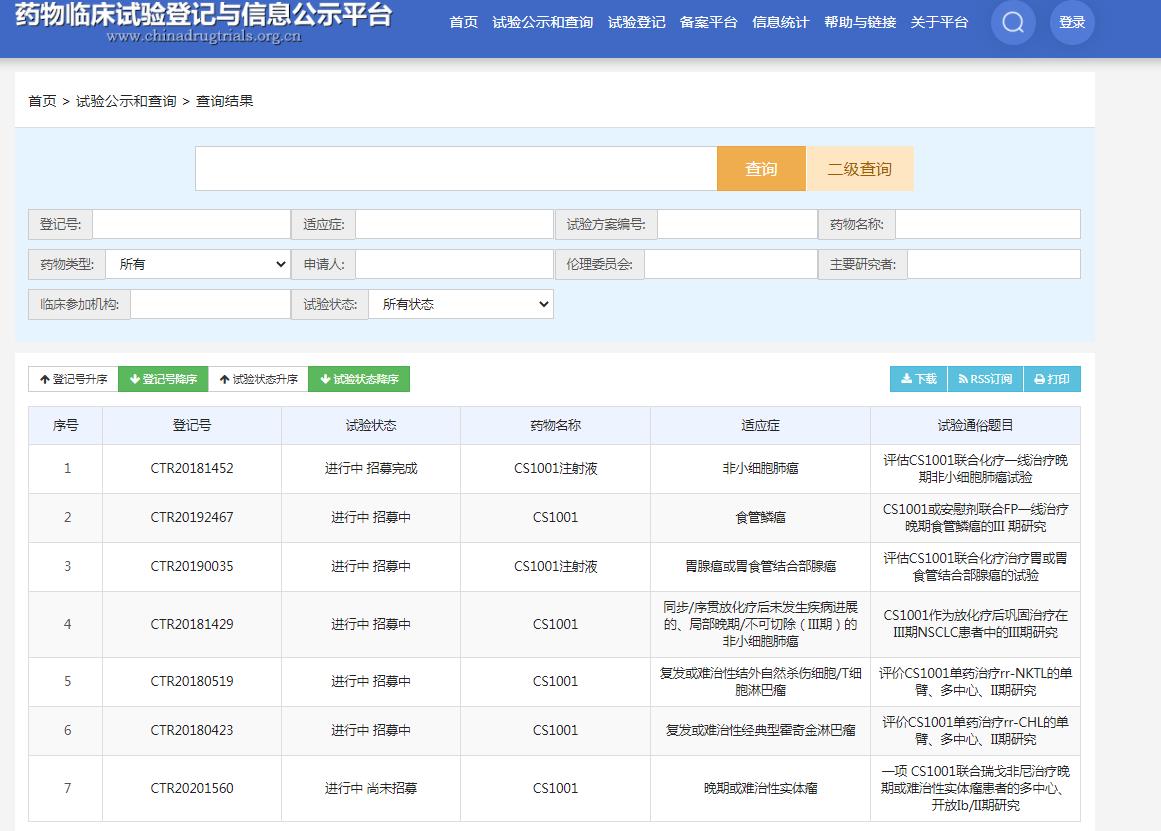
截圖來源:藥物臨床試驗登記與信息公示平臺
CS1001當前正在進行多項臨床試驗,除了一項美國橋接性1期研究之外,CS1001在中國正針對多個癌種開展一項多臂1b期臨床試驗,一項針對淋巴瘤的2期注冊臨床試驗,以及四項分別在III期、Ⅳ期非小細胞肺癌、胃癌和食管癌的3期注冊臨床試驗。
祝賀基石藥業的抗PD-L1抗體擬納入突破性治療品種,希望該產品的臨床開發進展順利,早日為患者帶來創新療法。
訂購需求
- *聯系人
- *聯系電話
- *咨詢品種
- 特殊備注
如緊急,請撥打
400-168-0606電話咨詢。




